ゲノム・遺伝子の基礎知識
ゲノムとは
ゲノムとは、生物の持つ染色体を含む全遺伝情報をいう。ヒトの場合、父と母からそれぞれ1セットずつ受け継いだ23対の染色体があり、1本の染色体はひとつながりのDNA分子を含んでいる。
DNA分子は二重らせんの「はしご」のような形状をしており、「はしご」の縦棒は糖とリン酸による一本鎖、「はしご」の横棒はA(アデニン)、C(シトシン)、G(グアニン)、T(チミン)という四種類の塩基が対になってできており、ヒトの場合この塩基対は約30億個あるとされる。
タンパク質コード遺伝子
このようなDNA分子の一部領域がタンパク質の生成に関係し、これをタンパク質コード遺伝子という。ヒトにはおよそ2万個のタンパク質コード遺伝子が存在するといわれる。タンパク質コード遺伝子はDNA分子の一部領域にのみ存在するが、最近ではそれ以外の塩基配列も遺伝子の働きを調整するなどの機能を有することが判明している。
遺伝子や塩基配列と関連する疾患は、以下の通り分類される 。
① 単一遺伝子疾患
特定の遺伝子によって引き起こされる疾患をいう。例として、ハンティントン病、嚢胞性線維症、鎌状赤血球貧血などが挙げられる。
② 他因子疾患
遺伝子のリスク因子の一つ一つの力はそれほど強くなく、そのいくつかが組み合わさって、さらに環境からの刺激を受けて疾患を引き起こすものをいう。
例えば、糖尿病や心臓病、がんなど、よくある病気のほとんどは遺伝的要素を持っているが、これらの疾患は単一の遺伝子ではなく、複数の遺伝子(塩基配列)や環境要因が関与している。
ゲノム医療の法的問題

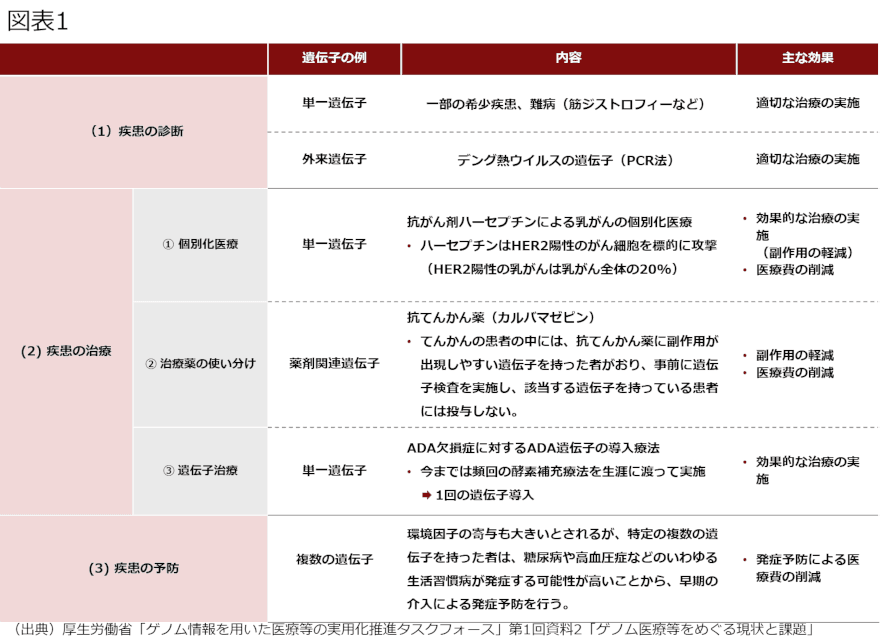
ゲノム医療は、(1)疾患の診断、(2)疾患の治療(個別化医療、治療薬の使い分け、遺伝子治療)、(3)疾患の予防などの様々な目的で実施される(図表1)。
特に、(2)疾患の治療のうち個別化医療や治療薬の使い分けは、がん医療の分野で注目を集めている。がん細胞に関わる多数の遺伝子を一度に調べる検査(パネル検査)を実施して、どの遺伝子に変異があるかを解析し、それに応じた治療方法(薬剤)を選択できるというものである。この6月1日から公的医療保険の適用対象となるパネル検査が現れた。
また、(3)疾患の予防として行われるゲノム医療の例として、例えば女性の乳がんや卵巣がんの発症確率を大きく高めるとされるBRCA遺伝子の変異を検査し、確認された場合には乳腺切除などの予防措置を講じるものが挙げられる。2013年に米女優のアンジェリーナ・ジョリーがこの手術を受けて注目された。
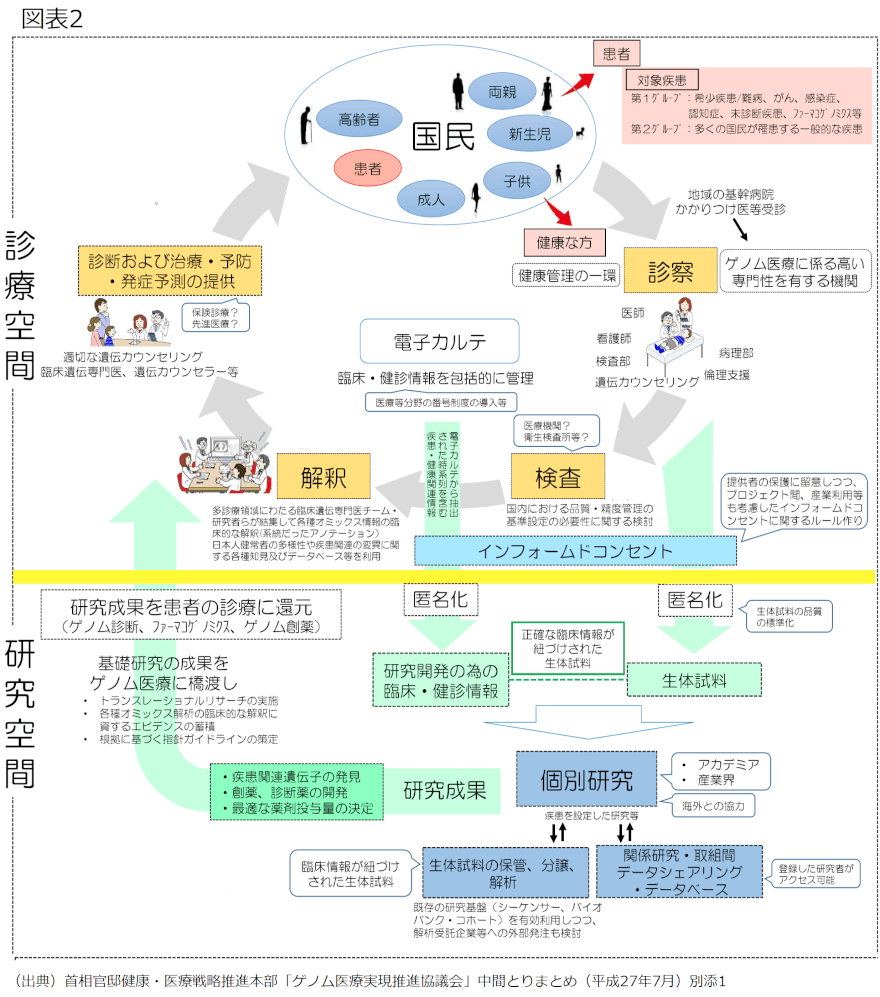
ゲノム医療においては診療と研究が一体で実施されることが想定されるが(図表2)、特に研究空間においては、文部科学省・厚生労働省・経済産業省が策定した「ヒトゲノム・遺伝子解析研究に関する倫理指針」を遵守する必要がある。
指針は、インフォームド・コンセント、遺伝カウンセリングといった提供者に対する姿勢や、試料・情報の保存及び廃棄や他の研究機関への提供といった試料・情報の取扱いなどについて定めている。
医療機関から検査を受託する検査所には、遺伝子関連の業務に関し相当の経験を有する医師若しくは臨床検査技師等を置くことが求められる(「臨床検査技師等に関する法律」20条の3第2項、同法施行規則12条1項12号)。
遺伝子検査に用いるためのDNAシークエンサー、試薬、解析プログラムなどの機器等については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」上の取扱い(例えば、医療機器、体外診断用医薬品、医療機器プログラム、コンビネーション医療機器のいずれに該当するかなど)を検討する必要がある。
患者から得られた遺伝・医療情報をデータベース化してAIによって分析し、新たな診療・治療方法の発見や製薬につなげることも期待されるが、そうしたノウハウ等に関する特許権も含めた知的財産権としての保護のあり方も議論されている。
遺伝子検査サービスの法的問題

遺伝子検査サービスとは、事業者が、医師を介さずに、個人(消費者)から採取された検体の遺伝情報を解析し、当該遺伝情報に特徴的な疾患リスクや体質に関する情報を提供するサービスである。消費者向け遺伝子検査(Direct-to-Consumer Genetic Testing:DTC)とも呼ばれる。
遺伝子検査サービスのプロセスは、典型的には、次のプロセスから構成される。
① 受付
検査事業者が、個人から遺伝子検査の申込みを受け付け、検査採取キット等を個人に送付する。
② 検体採取
個人が、検体採取キットにより自身で検体(唾液等)を採取し、検査事業者に送付する。
③ 解析
検査事業者が、個人から送付された検体を解析する(検査機関等に解析が委託される場合もある)。
④ 結果報告
検査事業者が、解析結果を郵送やウェブサイト等を通じて個人に報告する。
⑤ 処置
検査事業者が、遺伝子検査の結果を基に、栄養又は運動指導、サプリメントの販売などの疾患罹患リスクの低減等を図るサービス(二次的サービス) を提供する(オプション的なサービスとして提供される場合が多い)。
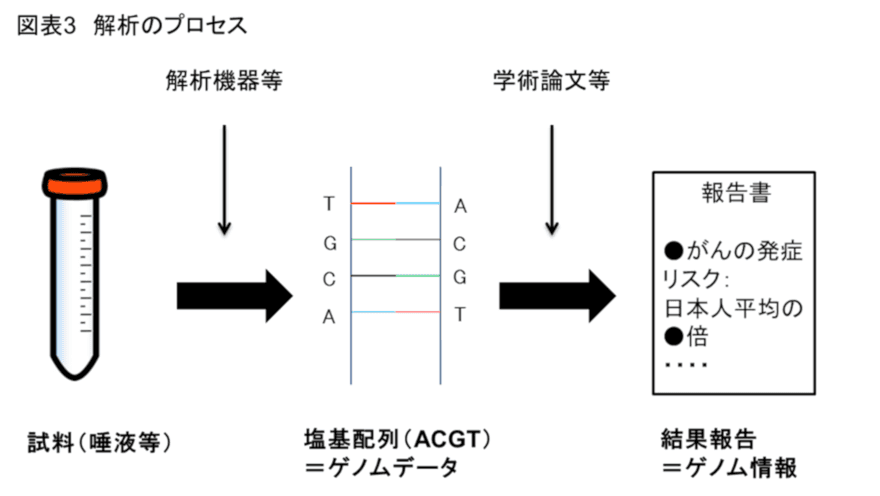
このうち③解析は、(i)解析機器等により個人(消費者)から送付された検体(唾液等)に含まれる塩基配列(ACGT)を文字列で表記したもの(ゲノムデータ)を明らかにする作業と、(ii)当該ゲノムデータを(ゲノムデータと疾患との関係を明らかにする)学術論文や統計データ等に照らし合わせて個人の疾患リスクや体質(ゲノム情報)を明らかにする作業から構成される(図表3)。
こうした遺伝子検査サービスのうち、特に疾患リスクを明らかにするものについては、「医業」に該当しないかが問題となる。医師法17条は医師でなければ「医業」をしてはならないと定めており、「医業」に該当するサービスを医師(医療機関)でない事業者が提供すると同条に抵触してしまうためである。
前述のゲノム医療の法的問題で述べたゲノム医療との境界の問題ともいえる。この点については、①遺伝要因だけでなく、環境要因が疾患の発症に大きく関わる「多因子疾患」のみを対象としており、②学術論文等の統計データと検査結果とを比較しているにすぎない場合には、「医業」を行っているとはいえず、医師の関与なしに実施できる場合があると解されている。
また、遺伝子検査サービスの実施にあたっては、経済産業省が策定した「経済産業分野のうち個人遺伝情報を用いた事業分野における個人情報保護ガイドライン」を遵守する必要がある。
ガイドラインは、遺伝子検査サービスを提供する事業者に対して、個人(消費者)からのインフォームド・コンセントの取得や検体の厳格な管理、分析的妥当性や科学的根拠に基づく解析、遺伝カウンセリングなどの規律を定めている。
保険会社は危険選択に遺伝情報を用いることができるか

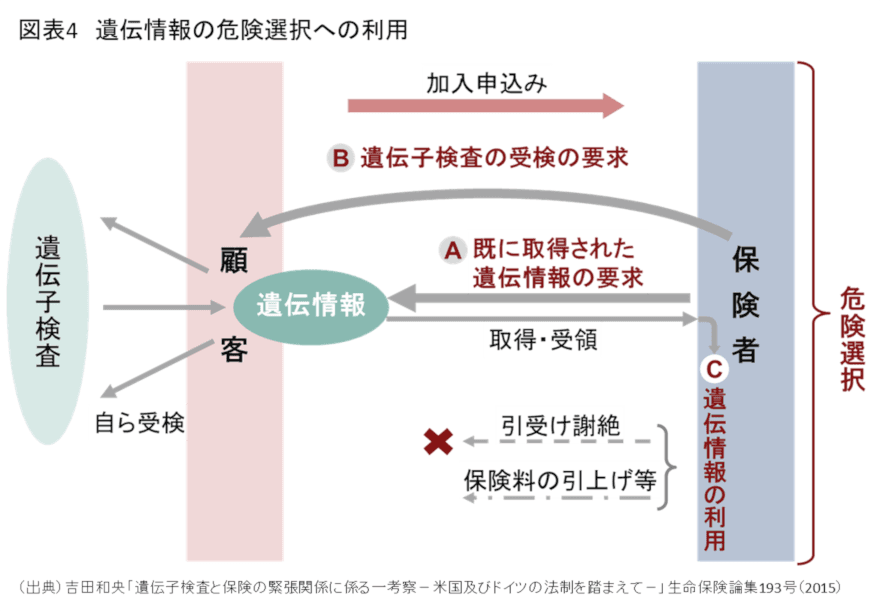
ゲノム医療や遺伝子検査サービスが普及してくると、保険会社が危険選択(保険の引受け)において、顧客に遺伝子検査の結果の開示や受検を求めたり、その情報を利用できるかが問題となる(図表4)。
例えば、Aさんが遺伝子検査を受けて、将来アルツハイマー病になるリスクが高いことが判明したとする。この場合、Aさんは将来に備えて介護保険に加入することができるか。
保険会社の立場からすれば、Aさんは将来アルツハイマー病になるリスクが高いことが判明したのであれば、保険の引受けの謝絶や保険料の引上げを検討するかもしれない。また、そのような遺伝情報を得るために、Aさんに対して遺伝子検査の結果の告知や遺伝子検査の受検を求めたいと考えるかもしれない。そうしないと、Aさんは自身のリスクが高いことを知りながら保険に加入するという「逆選択」を招くおそれがあるためである。
他方、Aさんの立場からすれば、自己の力で変えることのできない遺伝情報に基づいて保険の引受けが謝絶されたり、保険料が引き上げられたりすることは差別であると感じるかもしれない。
また、遺伝情報という究極のプライバシー情報を保険会社に伝えたくないと思うかもしれない。自己の遺伝情報は知りたくないとして、保険会社から遺伝子検査の受検を求められることは不当であると考えるかもしれない。
このように、保険会社が顧客に遺伝子検査の結果の開示や受検を求めたり、その情報を利用することについては、保険会社と顧客のそれぞれの立場から様々な議論が想定される。
このような問題について、海外では保険会社が遺伝子検査・情報を要求したり利用することを一定の範囲で禁止する立法がある。
例えば、米国では2008年に連邦法レベルでGenetic Information Nondiscrimination Act(遺伝情報差別禁止法)が成立し、ドイツでは2009年にGesetz über genetische Untersuchungen bei Menschen(Gendiagnostikgesetz – GenDG)(遺伝子診断法)が成立している(図表5)。
他方、我が国では2000年代前半に活発に議論が行われたが、具体的な法制化や指針等の実現には至っていない。
もっとも、我が国の保険実務では、現在のところ、引受審査の際に、遺伝子検査結果の利用は行われていないとされている。2017年末には、複数の保険会社の約款に遺伝情報を利用するかのように読める記載が見つかったとして、金融庁が各社に当該記載の削除を要請した経緯もある。
最近では、生命保険協会が、保険の引受審査の際に遺伝子検査結果の収集や利用はしないことを定めた指針を策定する動きもあると報じられている。
ゲノム編集の法的問題
ゲノム医療や遺伝子検査サービスはゲノム情報を解析して医療や健康増進に役立てるものであるが、近時、ゲノムそのものを改変するゲノム編集という新たな技術が現れている。
ゲノム編集技術とは
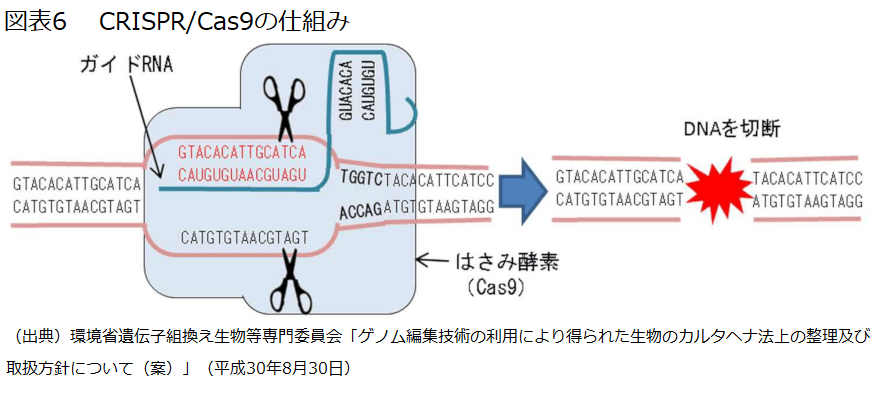
ゲノム編集技術とは、生物のゲノムの狙ったDNA 配列を認識する部分と、そこを特異的に切断する人工の分解酵素からなるものを用い、細胞の持つDNA 修復機構を利用して、切断による遺伝子の不活性化又は切断箇所への人工のDNA 断片の挿入等により、ゲノムの改変を行う技術である。
①ZFN(Zinc Finger Nuclease)、②TALEN(Transcription Activator-Like Effector Nuclease)、③CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats / CRISPR-associated Protein 9)が知られているが、特に③CRISPR/Cas9(図表6)は、狙いどおりのゲノム編集を容易に行うことができるものとして急速に普及している。
ゲノム編集類型
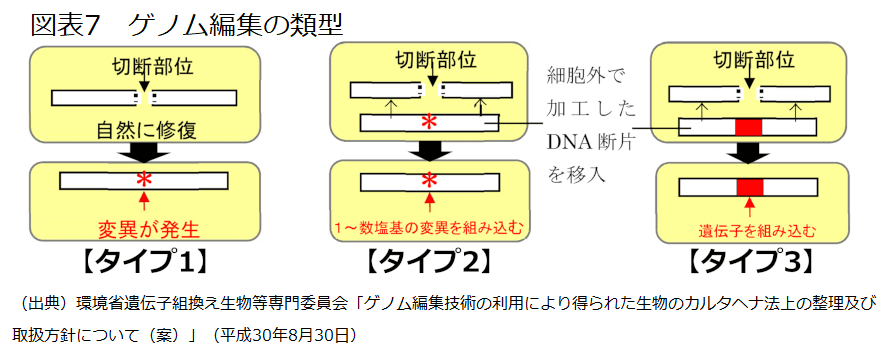
ゲノム編集の類型は、①宿主の標的塩基配列を切断後、自然修復の際に変異(塩基の欠失、挿入又は置換)が発生する類型(タイプ1)、細胞外で加工したDNA断片を挿入することにより、標的塩基配列を切断後、切断部位が修復される際に、②外来の塩基が組み込まれる類型(タイプ2)、③外来の遺伝子が組み込まれる類型(タイプ3)に分類することができる(図表7)。
このようなゲノム編集をヒトの受精胚に施した場合、ヒトが望みどおりの子供を創造できるというデザイナーベビーの問題など、様々な倫理上の懸念が生じる。現に昨年11月、中国の研究者が、エイズに罹患していた父のウイルスが子に感染しないようにするために、ゲノム編集技術で改変したヒト受精胚から世界で初めて子を誕生させたと発表し、世界中から大きな批判を集めた。
こうした懸念を受け、我が国では本年4月1日に「ヒト受精胚に遺伝情報改変技術等を用いる研究に関する倫理指針」(平成31年文部科学省・厚生労働省告示第3号)が公表され、ゲノム編集を施したヒト受精胚の胎内移植を禁止するなどの措置が講じられている。
他方、ゲノム編集技術による農産物の品種改良は、我が国の農林水産業の成長産業化の観点からも期待されている。例えば、国内で開発中のものとして、「超多収イネ」、「甘くて長持ちトマト」、「芽が出ても安心ジャガイモ」、「切っても涙が出ないタマネギ」、「肉厚マダイ」などが挙げられる(※)。
田部井豊「新たな育種技術(New Plant Breeding Techniques : NPBT)」(2018年12月18日開催薬事・食品衛生審議会食品衛生分科会新開発食品調査部会資料)。
もちろん、このような農産物については、生態系に悪影響が生じないかや、食品としての安全性を確保できるのかといった懸念が示されている。
具体的には、①「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」(通称カルタヘナ法)の規制を受ける「遺伝子組換え生物等」(同法2条2項)に該当するか、②「食品衛生法」の規制を受ける「組換えDNA技術」(同法11条、食品、添加物等の規格基準(昭和34年厚生省告示第370号)第1、A、2)に該当するかという問題として議論されている。
この問題については、昨年から環境省や厚生労働省において検討が進められ、少なくとも、①宿主の標的塩基配列を切断後、自然修復の際に変異(塩基の欠失、挿入又は置換)が発生する類型(タイプ1)については、従来の育種技術等との区別が容易でないことから、規制の対象外とする方向性が示されている。ただし、規制の対象外となる場合であっても、当局に対する一定の報告や届出は求められる。
おわりに

以上で述べた通り、ゲノム・遺伝子ビジネスには様々な法的問題が存在するが、まだ黎明期であるが故にルールが確定していない部分が多く、生命や環境倫理の観点から社会全体での議論が期待される事項もある。ビジネスの実施にあたっては、こうした議論も含めた最新の動向に注視する必要がある。

- 寄稿
-
森・濱田松本法律事務所吉田 和央 氏
弁護士